Вопросы защиты конкуренции на фармрынках ЕАЭС и соблюдение прав их участников обсудили 27 сентября 2021 года в Москве министр по конкуренции и антимонопольному регулированию ЕЭК Арман Шаккалиев, эксперты Комиссии ЕЭК и представители фарминдустрии.
Мероприятие организовано Ассоциацией международных производителей медицинских изделий IMEDA и стало первым в серии запланированных встреч бизнеса с экспертами Комиссии по вопросам антимонопольного регулирования трансграничных рынков лекарственных средств и медицинских изделий.
Правовая база общего рынка лекарственных средств и медицинских изделий сформирована и действует на территориях стран ЕАЭС с 2017 года. В период пандемии и после неё эти рынки получили динамичное развитие.
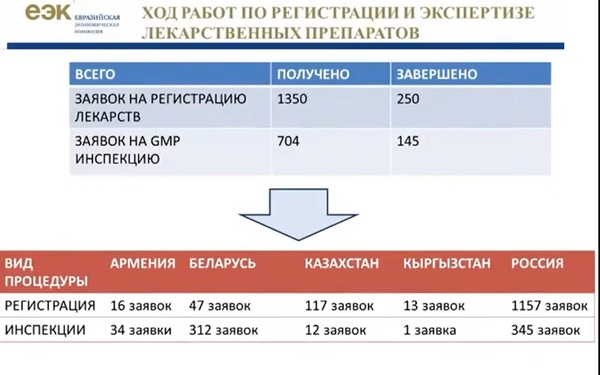 В целом, на едином фармацевтическом рынке обращается более 15 000 наименований лекарственных средств, функционирует 27 000 производственных площадок. Регистрация препаратов и приведение производственных площадок в соответствие с правилами ЕАЭС потребует от участников рынка огромных усилий. На данный момент принято 1 350 заявок на регистрацию и 704 заявки на инспекцию на соответствие GMP. Безусловным лидером по количеству принятых на заявок является Россия (на регистрацию - 1 157 заявок, на инспектирование GMP - 345 заявок).
В целом, на едином фармацевтическом рынке обращается более 15 000 наименований лекарственных средств, функционирует 27 000 производственных площадок. Регистрация препаратов и приведение производственных площадок в соответствие с правилами ЕАЭС потребует от участников рынка огромных усилий. На данный момент принято 1 350 заявок на регистрацию и 704 заявки на инспекцию на соответствие GMP. Безусловным лидером по количеству принятых на заявок является Россия (на регистрацию - 1 157 заявок, на инспектирование GMP - 345 заявок).
Среди актуальных вопросов, требующих решения, участники встречи назвали:
- упрощение процедуры регистрации лекарственных препаратов,
- Обеспечение доступа системы здравоохранения к современным лекарствам, расширение возможностей лечения редких заболеваний,
- разгрузка фармацевтических инспекторатов государств-членов при переходе к новым правилам инспектирования на соответствие GMP.
 Пути решения этих вопросов участники видят в:
Пути решения этих вопросов участники видят в:
- введении упрощенной процедуры регистрации для отдельных групп лекарственных препаратов, в частности препаратов с неудовлетворенным спросом,
- введении особых режимов регистрации для орфанных и высокотехнологичных лекарств,
- дистанционном инспектировании, продление переходного периода, в течение которого компании могут предоставлять национальных сертификаты на соответствие GMP до 31 декабря 2021 года.
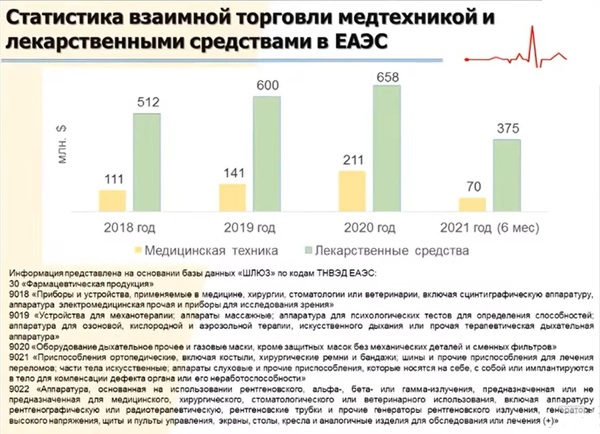
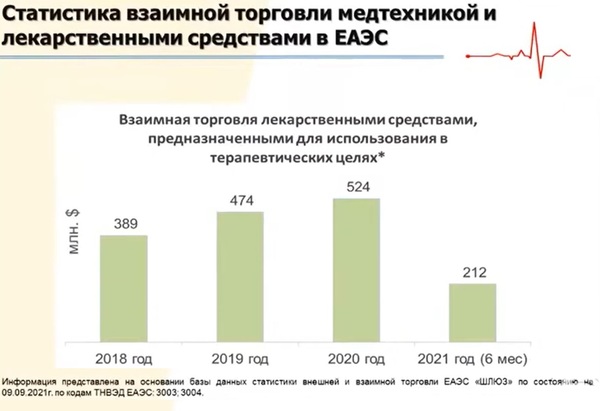
Согласно отчетам аналитиков, ежегодный прирост объемов фармрынка ЕАЭС составляет 10–12%. В 2024 году, по прогнозам, он может достигнуть 40 млрд долл. США. Это крупнейший рынок ЕАЭС. Так, по статистическим данным, взаимная торговля медицинской техникой с 2018 года по 2020 года увеличилась со 111 до 658 млн $, лекарственными средствами - с 512 до 658 млн $. Обороты лекарственных средств, предназначенных для использования в терапевтических целях, возросли с 389 в 2018 году до 524 млн $ в 2020 году. При этом национальная регистрация никак не может сдерживать такие потоки, и конечно, эти рынки, по сути, являются трансграничными.
 Представители Комиссии, рассказывая о правоприменительной практике ЕЭК, отметили, что соглашения производителей и дистрибьюторов медицинской техники и лекарственных средств должны учитывать реалии ЕАЭС – единое экономическое пространство и общий рынок товаров. Эксперты отметили необходимость для производителей исключить из договоров сегментацию рынка по территориальному принципу, а также обозначили, что ограничения по территории продаж должны быть экономически обоснованы и применяться только в исключительных случаях.
Представители Комиссии, рассказывая о правоприменительной практике ЕЭК, отметили, что соглашения производителей и дистрибьюторов медицинской техники и лекарственных средств должны учитывать реалии ЕАЭС – единое экономическое пространство и общий рынок товаров. Эксперты отметили необходимость для производителей исключить из договоров сегментацию рынка по территориальному принципу, а также обозначили, что ограничения по территории продаж должны быть экономически обоснованы и применяться только в исключительных случаях.
Говоря о новеллах в сфере правового регулирования, особое внимание бизнеса представители ЕЭК обратили на один из инструментов «мягкого регулирования» – предупреждение, который действует с июля текущего года и дает бизнесу возможность оперативно устранить недобросовестную практику поведения и тем самым избежать штрафов.
В завершение встречи представители фармотрасли озвучили ряд вопросов, в том числе касающихся использования товарных знаков, параллельного импорта, правоприменительной практики норм Договора о ЕАЭС, и другие.
Подробнее смотрите по ссылке https://www.youtube.com/watch?app=desktop&v=G9m0DQ2JM0w



